1.물 분자의 직접 해리 및 흡착
금속 산화물 또는 반도체 산화물(예: Ti4+, Fe3+)의 불포화 금속 부위에서 물 분자는 먼저 분자 형태로 흡착된 다음 O-H 결합 절단으로 인해 다리 또는 말단 수산기 그룹(M-OH)과 표면 수소 원자가 생성됩니다. 이 과정의 열역학적 원동력은 금속 이온의 강한 루이스 산성에서 비롯되어 물 분자를 쉽게 해리시킬 수 있습니다. 실험과 DFT 계산 모두 낮은 산소로 덮인 표면은 해리되고 흡착되는 경향이 있는 반면, 높은 산소로 덮인 표면은 분자를 흡착하는 경향이 있음을 나타냅니다.
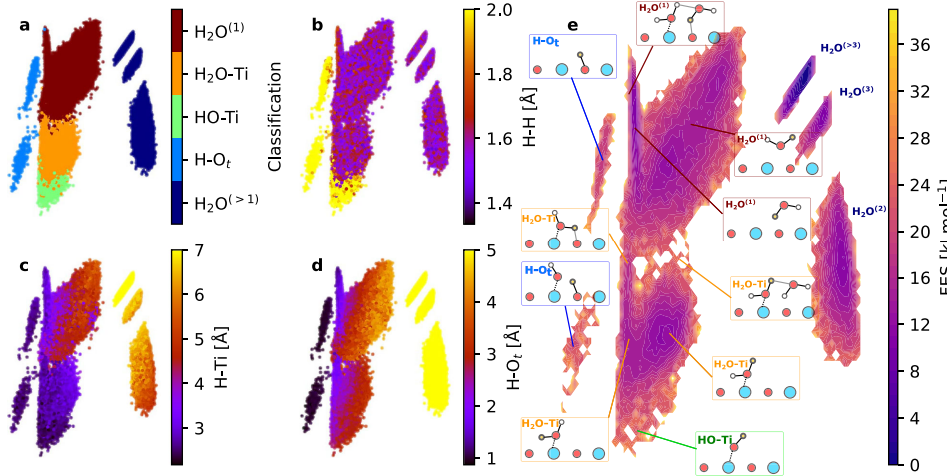
2.산소 결손(VO) 매개 수산기 생성
표면 산소 결손은 전자를 제공하여 흡착된 물 분자가 해리되기 쉽게 만듭니다. 물 분자가 빈 공간에 흡착된 후 두 개의 수산기가 생성되며, 그 중 하나는 빈 공간을 채우고 다른 하나는 인접한 금속에 매달려 있습니다. 이 메커니즘은 환원이나 고온 조건에서 수산기 밀도가 크게 증가하는 현상을 설명하며, 금속 이온의 배위수 변화와 밀접한 관련이 있습니다.
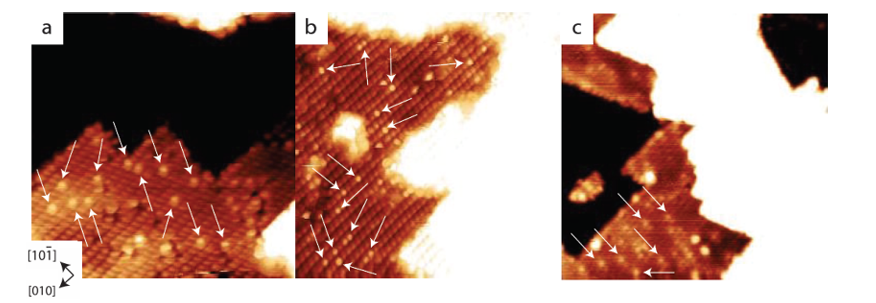
3.수소 또는 수소 원자 오버플로
금속/산화물 경계면에서 H2는 금속 위에서 해리되어 H ⁺/H ⁻를 형성한 다음 수소 오버플로를 통해 금속 산화물의 표면으로 이동하고 표면 산소와 함께 수산기를 형성합니다. 이 과정은 저온 CO 산화와 같은 촉매 시스템에서 직접 관찰되었으며, 수소 오버플로는 표면 수산기 생성 속도를 크게 증가시켰습니다.

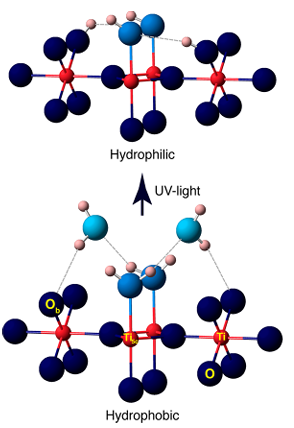
4.광촉매/UV 유도 수산기 형성
UV 빛은 TiO2와 같은 반도체를 자극하여 전자 정공 쌍을 생성하고, 이는 표면 산소 원자를 포획하여 O⁻를 형성한 다음 흡착된 물 분자 또는 수산기와 반응하여 표면 OH⁻를 생성하고 수산기 라디칼(·OH)의 생성을 동반합니다. 실험에 따르면 UV 조사는 TiO2 표면에 추가 산소 공극을 생성하고, 이는 물과 추가로 반응하여 더 많은 수산기를 생성하여 광 유도 초친수성을 유도하는 것으로 나타났습니다.
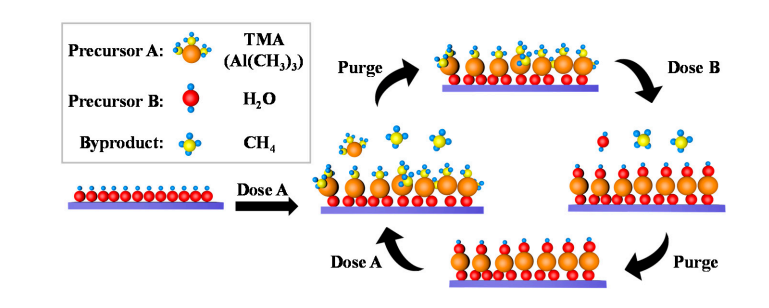
5.산화알루미늄 표면의 수산기 형성
산화알루미늄 표면에는 자연적으로 소량의 수산기가 존재하며, 이 수산기에 물 분자가 해리 및 흡착되어 새로운 Al-OH를 생성합니다. 원자층 증착(ALD) 중에 TMA(트리메틸알루미늄)는 표면 수산기와 배위 교환을 거쳐 Al-O-Al 결합을 형성하고 메탄을 방출합니다. 이어서, 물 펄스는 Al-O 결합과 다시 반응하여 표면 수산기를 재생하고 수산기의 순환 재생을 달성합니다.
6. 표면 재구성 - 금속 이동으로 수산기 응집이 발생합니다.
알루미나 또는 산화티타늄의 결정 표면에서는 국소적인 금속 이온(예: Al3+)이 고온 또는 높은 수화학적 전위 하에서 표면 공극으로 이동하여 Al(OH)3 또는 Ti(OH)3 유형의 수산기 클러스터를 형성합니다. 이러한 재구성은 격자 왜곡을 동반하며, 이는 인접한 물 분자에 대한 수산기의 흡착을 더욱 유리하게 만들어 고밀도 수산기 기본 층을 형성합니다.
7. 실리콘 표면의 수산기 가수분해 메커니즘
Si-O-Si 브리지 결합에서 물 분자는 시너지 양성자 전자 전달을 통해 실리콘 산소 결합과 결합하여 Si-OH 그룹을 형성합니다. 이 과정은 균열 팁의 응력 부식과 유리의 표면 가수분해에 특히 중요하며, Si-OH 인장 진동의 향상은 실험적 적외선 분광법을 통해 직접 관찰되었습니다.